近日,广东省人民医院胰腺外科教授陈汝福团队联合多家研究机构,阐明PDPN+ CAFs(Cancer-Associated Fibroblasts)通过外泌体递送非编码RNA PIAT片段至胰腺癌细胞调控YBX1依赖的m5C修饰,促进胰腺癌神经浸润的关键分子机制,为早期诊断及靶向胰腺癌神经浸润提供的新的靶点,该研究成果“Extracellular vesicle–packaged PIAT from cancer-associated fibroblasts drives neural remodeling by mediating m5C modification in pancreatic cancer mouse models” 在国际权威期刊《Science Translational Medicine》在线发表。
胰腺癌被称为“癌中之王”,是最具侵袭性、预后最差的实体恶性肿瘤之一。神经浸润是指癌细胞侵入和沿着神经周围的间隙和神经束膜扩散的过程,是胰腺癌最为独特的生物学特征,绝大部分胰腺癌组织中存在PNI,也是胰腺癌不良预后的关键因素。针对胰腺癌容易侵犯神经,并沿着神经进行转移和复发的特点,广东省人民医院胰腺中心陈汝福教授在国内外率先提出胰周神经丛的完整清扫是降低术后复发的关键,从而建立并完善了“联合胰周神经清扫的胰头癌根治术”这一手术技术方式,使可切除胰头癌患者的无进展生存期延长22%,尤其术前CA19-9<200U/mL的患者无进展生存时间可延长73%。在此基础上,陈汝福团队深入探索胰腺癌神经浸润的潜在机制,以望为寻找干预、阻断胰腺癌神经浸润的药物靶点。
该研究发现,在严重神经浸润的胰腺癌患者中,PDPN+CAFs显著增多,这些细胞通过外泌体释放PIAT片段,直接影响胰腺癌细胞的侵袭行为。此外,胰腺癌细胞分泌的TNF-α可以激活PDPN+CAFs,形成一个自我强化的循环,从而加剧神经浸润。进一步的研究表明,PIAT通过外泌体进入肿瘤细胞后,与m5C识别蛋白YBX1及ELAVL1结合,抑制YBX1的降解,增强其与神经浸润相关基因的相互作用。这一机制通过稳定这些关键基因的mRNA,加剧了胰腺癌的神经浸润现象。值得注意的是,高水平的PIAT表达与较短的总生存期和无病生存期密切相关,血浆中的PIAT浓度比传统的CA19-9标志物更能准确预测胰腺癌神经浸润的发生。
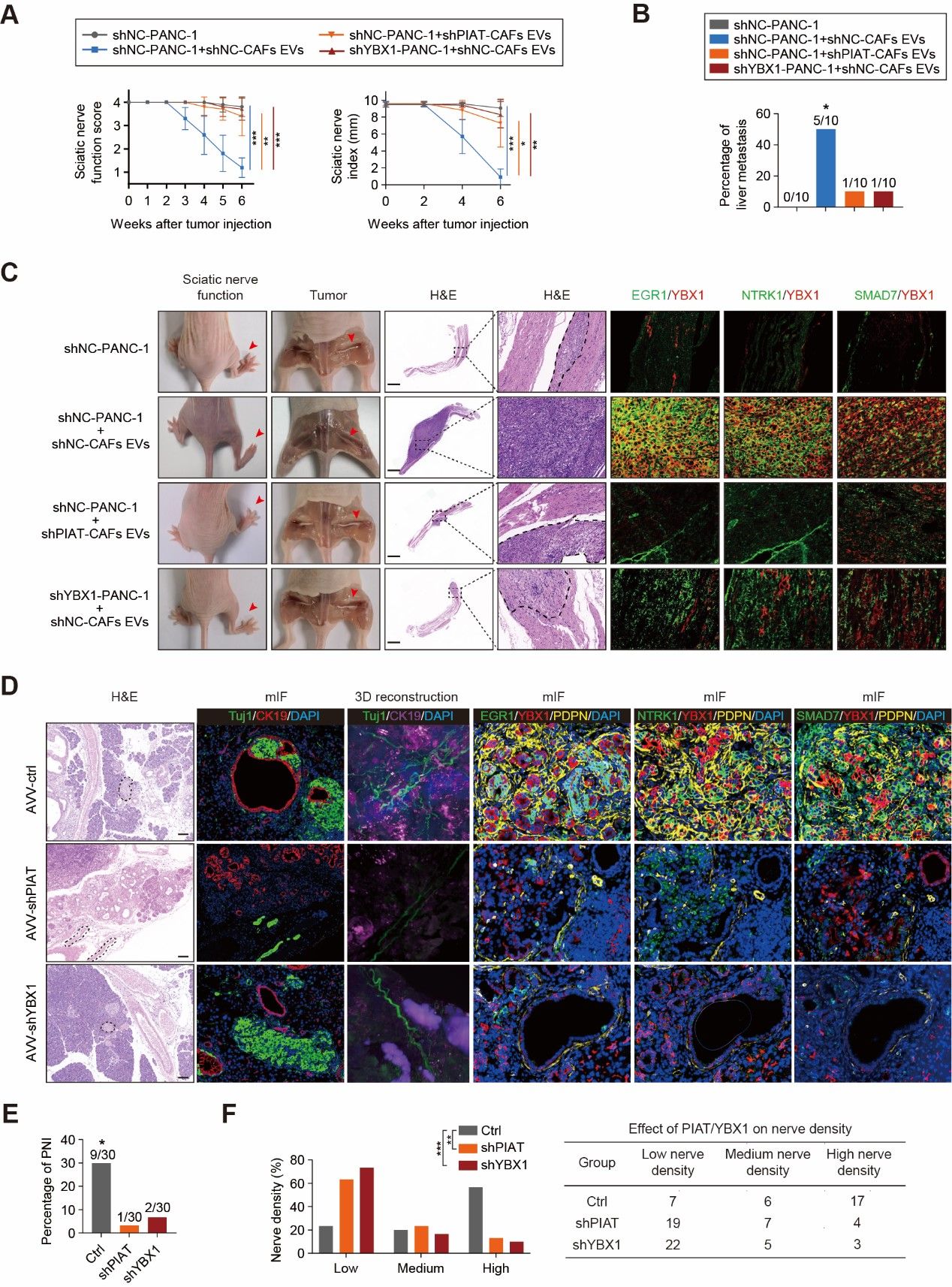
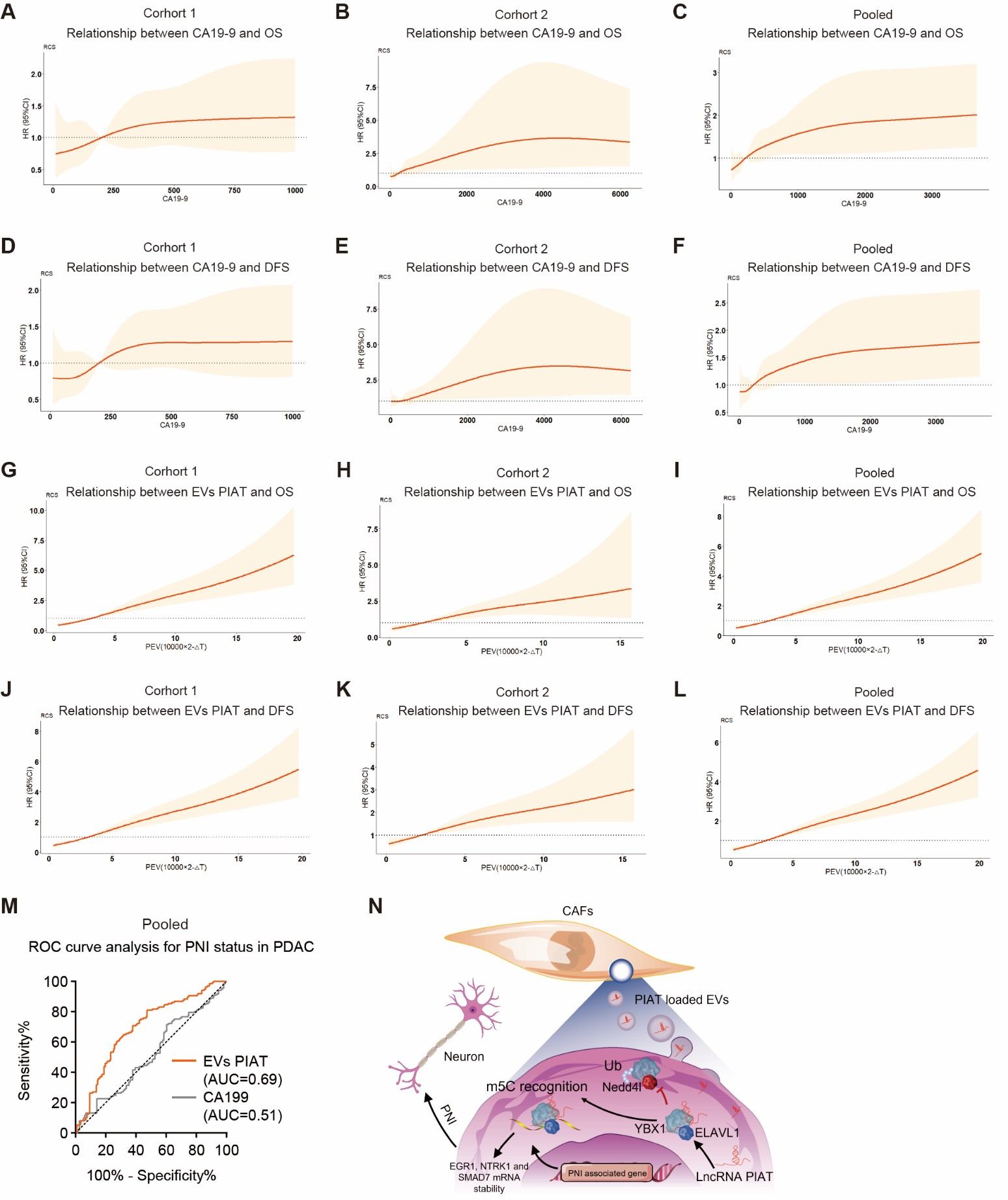
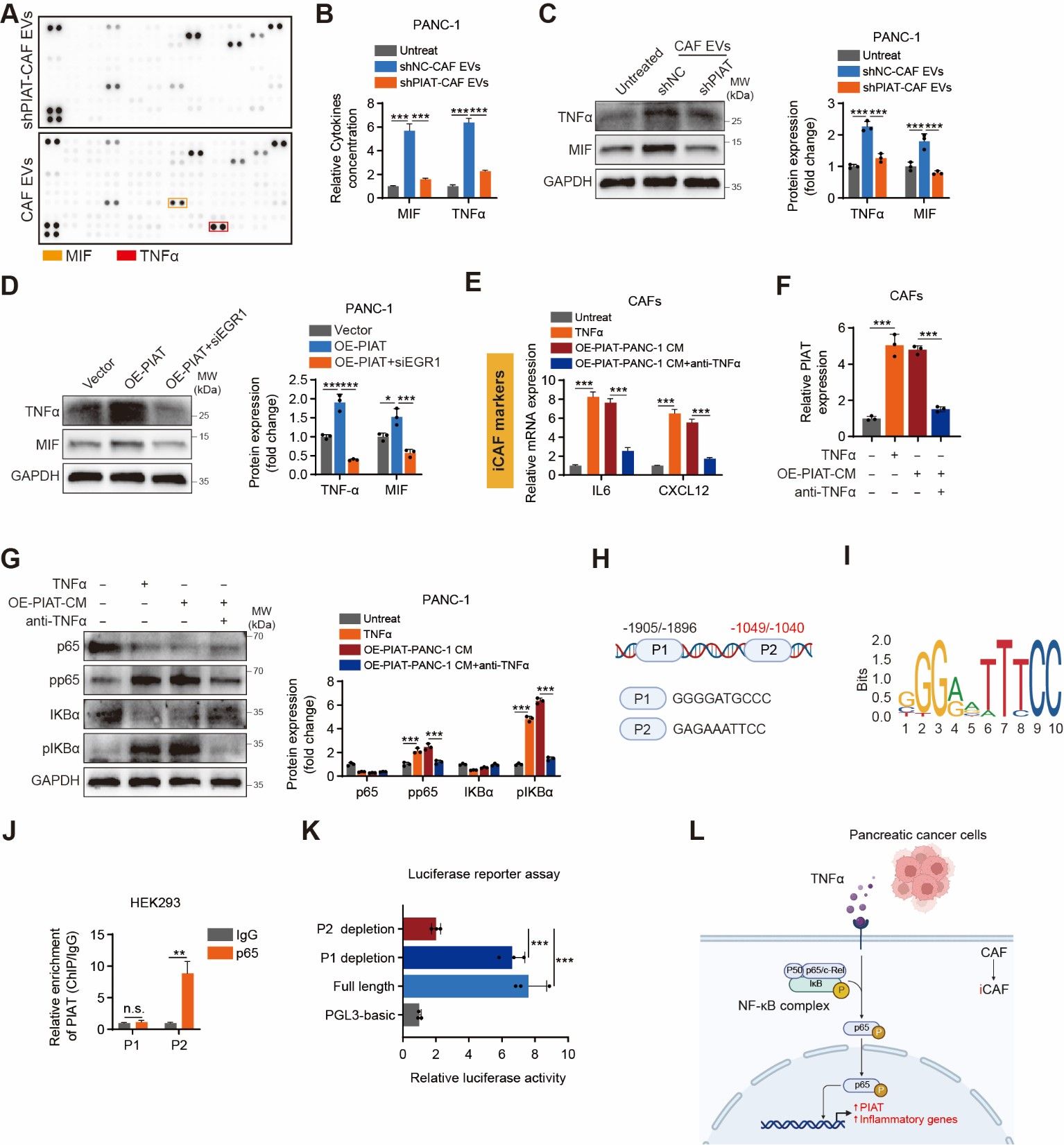
胰腺神经浸润微环境重塑新机制
该研究揭示了CAFs源性外泌体通过传递转录本调控m5C修饰促进胰腺癌神经浸润的精细机制,为表观遗传学和RNA转录后修饰在胰腺癌PNI中的作用提供了科学证据。这些发现对于开发针对肿瘤微环境的新疗法具有重要意义,并凸显了表观遗传修饰作为癌症治疗靶点的巨大潜力。
本项研究得到了国家自然科学基金、广东省基础与应用基础研究基金、以及广东省人民医院高层次引进人才基金的资助。陈汝福和周雨为本研究的共同通讯作者,郑上游、胡崇辉、林青和李婷婷为论文共同第一作者。