近日,我校基础医学院张璐、张琳团队在Brain杂志(中科院1区)发表了题为“Cdc42GAP deficiency contributes to the Alzheimer’s disease phenotype”的研究论文。南方医科大学基础医学院博士肖彬、祝梦娟为共同第一作者,张璐、张琳教授为共同通讯作者。
阿尔兹海默病(AD)是目前世界范围内发病率第一的神经退行疾病。Cdc42属于小G蛋白Rho家族,Cdc42GAP是Cdc42活性的负调控因子,调控其从活性状态转化为非活性状态。研究团队引入了Cdc42持续激活突变小鼠(Cdc42GAP+/-,GAP)及阿尔茨海默病模型小鼠APP/PS1(AD),同时将两株小鼠杂交获得GAP/AD杂合小鼠,发现4月龄GAP小鼠出现学习能力下降、认知功能损伤,同时伴有神经元衰老、树突棘密度降低,GAP/AD小鼠损伤更严重,并且随年龄增加11月龄的GAP小鼠、GAP/AD小鼠损伤进一步加重。与此同时,发现11月龄GAP小鼠海马及皮质区出现与AD小鼠相似的Tau蛋白过度磷酸化及Aβ沉积,且GAP/AD杂合小鼠进一步加重。在细胞水平上,制备了Cdc42组成型激活和显性负效突变慢病毒,在小鼠海马及皮质原代神经元中验证了Cdc42持续激活参与调控神经元衰老、Tau蛋白过度磷酸化及树突棘密度丢失。
为了进一步阐明Cdc42持续激活诱导小鼠出现AD样症状及表型的机制,研究团队对11月龄GAP小鼠海马脑区进行了定量磷酸化修饰组学及蛋白组学的分析和验证,结果显示GAP小鼠海马区糖原合成酶激酶-3β(GSK-3β)活性增高,表现在其9位点及389位点磷酸化水平降低、216位点磷酸化水平升高,上述研究提示Cdc42持续激活可能通过激活GSK-3β 介导AD样表型的发生发展。有意义的是,研究团队在AD患者大脑皮质病理标本中验证了Cdc42通路的激活及GSK-3β活性的增加。该研究揭示了Cdc42通路参与调控AD发生发展的关键机制,为AD的治疗提供新靶点。
研究团队近年围绕小G蛋白Rho家族对神经精神疾病突触可塑性调控机制展开研究。先后报道Cdc42通路在药物成瘾记忆突触可塑性及成瘾相关行为中发挥重要作用(Biochim Biophys Acta Mol Basis Dis, Biol Psychiatry, Theranostics),并且Cdc42通路参与调控帕金森病突触重塑和行为异常(Aging Cell)。上述研究提示小G蛋白 Rho家族在神经精神疾病中功能的多样性与复杂性,及作为药物靶标的重要意义。
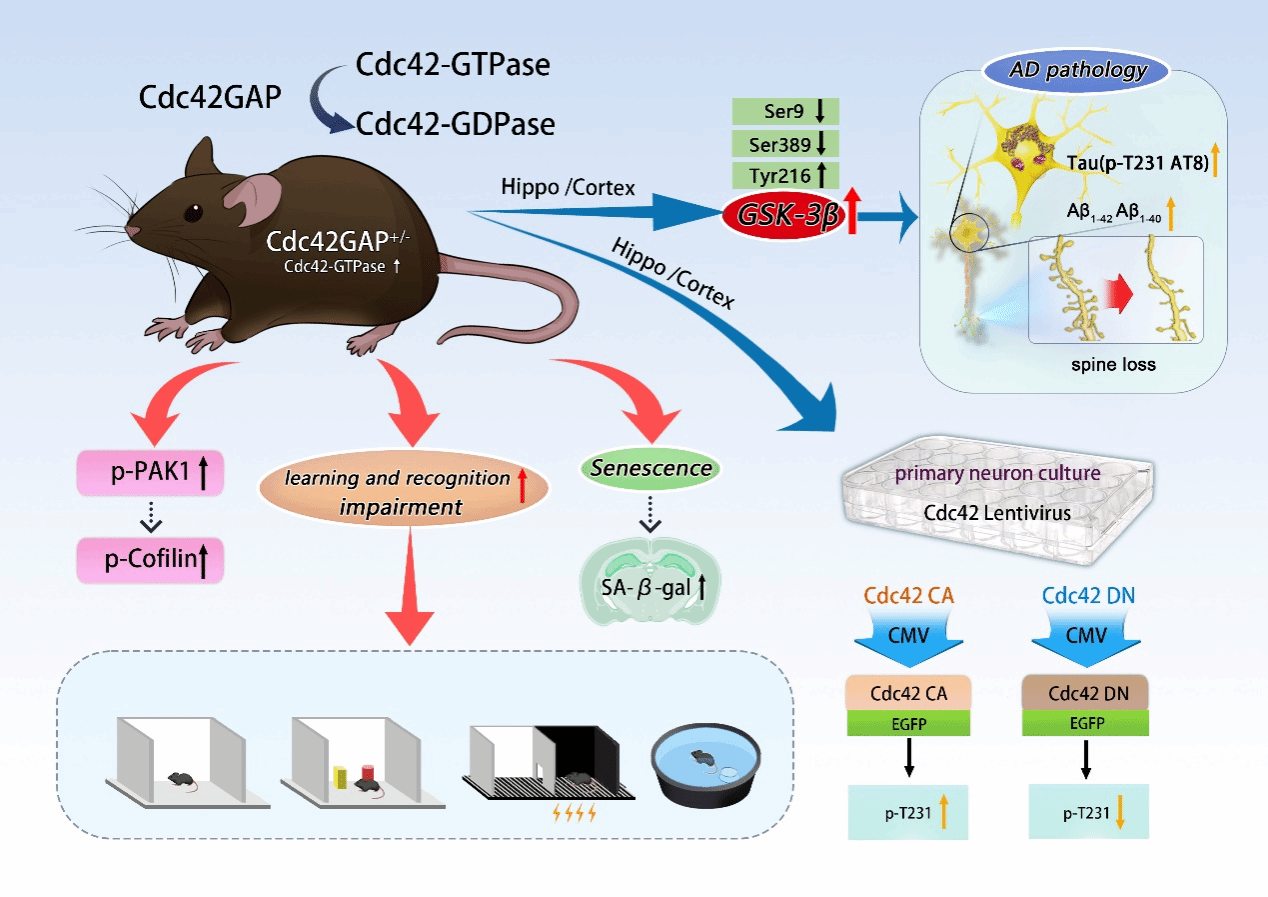
附图 Cdc42通路介导AD样表型的发生发展