6月23日,我校基础医学院余潇教授团队在Science Advances杂志(中科院一区)发表了以“VANGL2 inhibits antiviral IFN-I signaling by targeting TBK1 for autophagic degradation”为题的研究论文。
固有免疫(innate immunity)作为宿主抵抗病毒感染的第一道防线,其主要依赖于模式识别受体(PRR)和病原体相关分子模式(PAMP)之间的相互作用介导I型干扰素(IFN-I)的产生,发挥抗病毒免疫作用。但病毒感染同时会诱导产生多种负调控分子,这些负调控分子可通过多种方式靶向抑制IFN-I信号通路相关分子,进而促进病毒复制和免疫逃逸,因此探索抗病毒免疫反应的负调控分子,了解其背后的作用机制有利于抗病毒精准治疗和相关药物的研发。
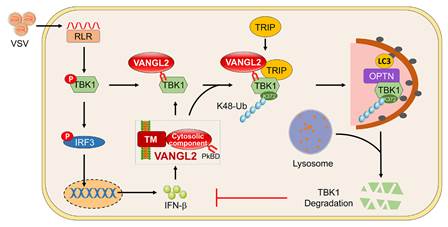
TBK1作为IFN-I信号通路中的关键激酶,可通过磷酸化IRF3使其细胞核转移,进而促进IFN-I的表达。既往研究表明,TBK1受到多种转录后修饰,如磷酸化、泛素化、SUMO化、乙酰化的调控。其中泛素化不仅可以调控TBK1的活化,也参与TBK1的蛋白降解。VANGL2作为平面细胞极性(Wnt/planar cell polarity,WNT/PCP)通路中的关键分子,在机体稳态、发育和组织器官修复过程中发挥着重要作用,但其在抗病毒感染免疫中的作用尚不清楚。
研究证实,RNA病毒感染可诱导VANGL2表达上调,且VANGL2的表达上调依赖于IFN-I,提示VANGL2是一种新型干扰素刺激基因。进一步研究发现,VANGL2在体内及体外实验中均能够显著抑制抗病毒免疫反应及促进病毒复制。机制上,VANGL2通过E3连接酶TRIP催化TBK1在K372位点发生K48类型的泛素化修饰。选择性自噬识别受体OPTN通过K48泛素链识别TBK1并将其输送至自噬溶酶体中进行降解。在机制上,本研究拓展了K48泛素链修饰的TBK1主要通过蛋白酶体途径降解的传统观点,明确了OPTN可以识别K48泛素链修饰的底物蛋白,确定了E3连接酶TRIP催化TBK1泛素化的赖氨酸残基,这些发现丰富了病毒感染过程中选择性自噬对于TBK1调控的认识。
综上该研究发现了VANGL2这一全新的干扰素刺激基因负反馈调控IFN-I通路及抗病毒固有免疫的关键作用,为抗病毒治疗提供了全新的分子靶点。
南方医科大学基础医学院胡志强、谢英超、卢键森、杨剑武及张佳环为论文的共同第一作者。南方医科大学基础医学院余潇教授为本文的通讯作者,该研究是余潇教授实验室在发现VANGL2作用于NF-kB通路进而调控脓毒血炎症反应(eLife,2023)的同期研究,进一步扩展了VANGL2作为固有免疫调控分子的认识。